ชนิดของธาตุ
ธาตุ คือ สารบริสุทธิ์ที่ประกอบด้วยอะตอมชนิดเดียวกัน มีสถานะต่าง ๆ ทั้งของแข็ง ของเหลวและก๊าซ ธาตุต่างชนิดกันสามารถรวมตัวหรือทำปฏิกิริยากันกลายเป็นสารประกอบชนิดต่าง ๆ ด้วยอัตราส่วนโดยมวลคงที่
เนื่องจากธาตุต่าง ๆ ในปัจจุบันนี้มีจำนวนมากกว่า 105 ธาตุ แต่ละธาตุมีสมบัติแตกต่างกันเป็นส่วนใหญ่ การที่จะศึกษาสมบัติของธาตุแต่ละชนิดนั้นเป็นเรื่องยุ่งยากและเสียเวลา ในทางปฏิบัติจึงจัดธาตุเป็นหมวดหมู่โดยตั้งเกณฑ์กำหนดต่าง ๆ กัน เช่น โดยอาศัยการนำไฟฟ้า โดยอาศัยสถานะ โดยอาศัยการจัดเรียงอิเล็กตรอน เป็นต้น ในบทนี้จะจัดธาตุออกเป็นหมวดหมู่โดยอาศัยสมบัติคลอไรด์ ออกไซด์ และซัลไฟด์ของธาตุ โดยในขั้นแรกจะศึกษาสมบัติของสารประกอบดังกล่าวสำหรับธาตุเพียง 20 ธาตุแรก แล้วนำสมบัติที่ได้มาจัดธาตุเป็นหมวดหมู่ ซึ่งจะเป็นจุดเริ่มต้นของการศึกษาสมบัติของธาตุอื่น ๆ และเป็นจุดเริ่มต้นของการจัดตารางธาตุที่ใช้อยู่ในปัจจุบัน

แนวโน้มความเป็นโลหะและอโลหะของธาตุในตารางธาตุ
ในภาวะปกติ ธาตุบางชนิดดำรงอยู่สถานะของแข็ง บางชนิดเป็นของเหลว และบางชนิดเป็นก๊าซ เราสามารถแบ่งสมบัติของธาตุทั้งหมดออกได้เป็นสามพวกใหญ่ๆ คือ โลหะ อโลหะ และกึ่งโลหะ
ตารางที่ 1 แสดงตัวอย่างของธาตุโลหะและอโลหะที่เราพอรู้จักกันดี
เงิน
เหล็ก
ปรอท
ตะกั่ว
สังกะสี
อะลูมิเนียม
โซเดียม
แมกนีเซียม
(ของแข็ง)
(ของแข็ง)
(ของเหลว)
(ของแข็ง)
(ของแข็ง)
(ของแข็ง)
(ของแข็ง)
(ของแข็ง)
ไนโตรเจน
ออกซิเจน
คลอรีน
โบรมีน
ไอโอดีน
กำมะถัน
อาร์กอน
คาร์บอน
(ก๊าซ)
(ก๊าซ)
(ก๊าซ)
(ของเหลว)
(ของแข็ง)
(ของแข็ง)
(ก๊าซ)
(ของแข็ง)
การที่เราจำแนกธาตุทั้งหลายออกเป็นโลหะกับอโลหะนั้น ก็เนื่องจากธาตุต่างๆ มีสมบัติเฉพาะตัวแตกต่างกัน แต่ก็มีสมบัติบางประการเหมือนกันหรือคล้ายกัน ซึ่งพอจะแยกออกเป็นสามพวกได้ดังนี้
1. โลหะ (metal) เป็นกลุ่มธาตุที่มีสมบัติเป็นตัวนำไฟฟ้าได้ นำความร้อนที่ดี เหนียว มีจุดเดือดสูง ปกติเป็นของแข็งที่อุณหภูมิห้อง (ยกเว้น ปรอท) เช่น แคลเซียม อะลูมิเนียม เหล็ก เป็นต้น
2. อโลหะ (non-metal) เป็นกลุ่มธาตุที่มีสมบัติไม่นำไฟฟ้า มีจุดหลอมเหลวและจุดเดือดต่ำ เปราะบาง และมีการแปรผันทางด้านคุณสมบัติทางกายภาพมากกว่าโลหะ เช่น ออกซิเจน กำมะถัน ฟอสฟอรัส เป็นต้น
ตารางที่ 2 แสดงสมบัติบางประการของโลหะกับอโลหะ
สมบัติ
|
โลหะ
|
อโลหะ
|
1. สถานะ
| เป็นของแข็งในสภาวะปกติ ยกเว้นปรอทซึ่งเป็นของเหลว ไม่มีโลหะที่เป็นก๊าซในภาวะปกติ | มีอยู่ได้ทั้ง 3 สถานะ ธาตุที่เป็นก๊าซในภาวะปกติจะเป็นอโลหะทั้งสิ้น อโลหะที่เป็นของเหลว คือ โบรมีน ของแข็ง ได้แก่ คาร์บอน กำมะถัน ฟอสฟอรัส เป็นต้น |
2. ความมันวาว
| มีวาวโลหะ ขัดขึ้นเงาได้ | ส่วนมากไม่มีวาวโลหะ ยกเว้น แกรไฟต์ (ผลึกคาร์บอน) เกล็ดไอโอดีน (ผลึกไอโอดีน) |
3. การนำไฟฟ้าและน้ำความร้อน
| นำไฟฟ้าและนำความร้อนได้ดี เช่น สายไฟฟ้ามักทำด้วยทองแดง | นำไฟฟ้าและนำความร้อนไม่ได้ยกเว้นแกรไฟต์ นำไฟฟ้าได้ดี |
4. ความเหนียว
| ส่วนมากเหนียว ดึงยืดเป็นเส้นลวด หรือตีเป็นแผ่นบ่างๆ ได้ | อโลหะที่เป็นของแข็ง มีเปราะดึงยืดออกเป็นเส้นลวดหรือตีเป็นแผ่นบางๆ ไม่ได้ |
5. ความหนาแน่น หรือความถ่วงจำเพาะ
| ส่วนมากมีความหนาแน่นสูง | มีความหนาแน่นต่ำ |
6. จุดเดือนและจุดหลอดเหลว
| ส่วนมากสูง เช่น เหล็ก มีจุดหลอดเหลว 1,536 oC จุดเดือด 3,000 oC | ส่วนมากต่ำโดยเฉพาะพวกอโลหะที่เป็นก๊าซ |
7. การเกิดเสียงเมื่อเคาะ
| มีเสียงดังกังวาน | ไม่มีเสียงดังกังวาน |
8. เกี่ยวกับอิเล็กตรอนและประจุไอออน
| เป็นพวกชอบให้อิเล็กตรอน ทำให้เกิดเป็นไอออนบวก | เป็นพวกชอบรับอิเล็กตรอน ทำให้เกิดเป็นไอออนลบ |
9. สารประกอบออกไซด์
| โลหะออกไซด์เป็นเบส | อโลหะออกไซด์เป็นกรด |
ประโยชน์ของธาตุ
1.4 อะตอมและโครงสร้างอะตอม
. ส่วนที่เล็กที่สุดของธาตุซึ่งเข้าทําปฏิกิริยาเคมีได้ อะตอม ประกอบด้วยอนุภาคมูลฐานที่สําคัญ คือ นิวเคลียสเป็นแกนกลาง และมีอิเล็กตรอนเคลื่อนที่อยู่โดยรอบ, เดิมเรียกว่า ปรมาณู.
โครงสร้างอะตอม
ดีโมครีตัส ( นักปราชญ์ชาวกรีก) ได้กล่าวว่าทุกสิ่งทุกอย่างประกอบขึ้นจาก อนุภาคที่เล็กมาก เล็กมากจนไม่สามารถมองเห็นได้ อนุภาคเล็กๆ เหล่านี้จะรวมพวกเข้าด้วยกันโดยวิธิการต่างๆ สำหรับอนุภาคเองนั้นไม่มีการเปลี่ยนแปลงและไม่สามารถจะแตกแยกออกเป็นชิ้นส่วนที่เล็กลงไปอีกได้ ดีโมครี- ตัสตั้งชื่ออนุภาคนี้ว่าอะตอม (Atom) จากภาษากรีกที่ว่า atoms ซึ่งมีความหมายว่า ไม่สามารถแบ่งแยกได้อีก ตามความคิดเห็นของเขา อะตอมเป็นชิ้นส่วนที่เล็กที่สุดของสสารที่สามารถจะคงอยู่ได้ภาพการแปรียบเทียบขนาดของอะตอม
ประโยชน์จากการเรียนเรื่องโครงสร้างอะตอม
1. ทราบสมบัติทางเคมีและสมบัติการเปล่งแสงของธาตุ
2. เราสามารถศึกษาแกแล็กซี่ (galaxy) ดวงดาวและดาวเคราะห์ต่างๆ โดยพิจารณาจากการศึกษาสเปกตรัมที่ได้จากดวงดาวแบบจำลองอะตอมของจอห์นดอลตันจอห์น ดอลตัน นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอมโดยอาศัยข้อมูลจากการทดลองที่พอจะศึกษาได้และนับว่าเป็นทฤษฎีแรกที่เกี่ยวกับอะตอมที่พอจะเชื่อถือได้ ซึ่งมีใจความดังนี้
- สารทุกชนิดประกอบด้วยอนุภาคขนาดเล็กที่สุดเรียกว่า “ อะตอม”
- อะตอมจะไม่สามารถแบ่งแยกได้ และไม่สามารถสร้างขึ้นใหม่ได้
- อะตอมของธาตุชนิดเดียวกันจะมีสมบัติเหมือนกันทุกประการ
- อะตอมของธาตุต่างกันจะมีสมบัติต่างกัน
- ธาตุตั้งแต่สองชนิดขึ้นไปสามารถรวมตัวกันเกิดเป็นสารประกอบ โดยมีอัตราส่วนการรวมตัวเป็นตัวเลขอย่างง่าย เช่น CO CO 2
จากทฤษฎีอะตอมของดาลตัน แบบจำลองอะตอมมีลักษณะดังรูป ลักษณะแบบจำลองอะตอมของดอลตัน( ตามทฤษฎีอะตอมของดอลตัน อะตอมในแนวคิดปัจจุบัน ข้อ 1, 3, 4 ใช้ไม่ได้ในปัจจุบัน)
ลักษณะแบบจำลองอะตอมของดอลตัน( ตามทฤษฎีอะตอมของดอลตัน อะตอมในแนวคิดปัจจุบัน ข้อ 1, 3, 4 ใช้ไม่ได้ในปัจจุบัน)
ข้อ 1. อะตอมไม่ใช่สิ่งที่เล็กที่สุด อะตอมยังประกอบด้วยอนุภาคอิเล็กตรอน, โปรตอน, นิวตรอน เป็นต้น
ข้อ 3 - 4 อะตอมของธาตุชนิดเดียวกันมีคุณสมบัติทางกายภาพไม่เหมือนกัน กล่าวคือมีมวลไม่เท่ากัน ซึ่งจะได้กล่าวต่อไป ในเรื่อง " ไอโซโทรป"แบบจำลองอะตอมของทอมสัน
- ทอมสัน ค้นพบ อิเล็กตรอน
- การทดลองของรอเบิร์ด แอนดรูส์ มิลลิแกน ได้ผลการทดลองว่า อิเล็กตรอนมีประจุไฟฟ้าเท่ากับ 1.60 x 10 -19 คูลอมบ์ และอิเล็กตรอนมีมวลเท่ากับ 9.11 x 10 -28 กรัม
- โกลด์สไตน์ ค้นพบ โปรตอน
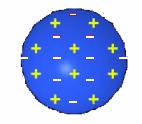
จากผลการทดลองของทอมสัน โกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้นเขาจึงเสนอแบบจำลองอะตอมว่า
- อะตอมมีลักษณะเป็นทรงกลม
- อะตอมไม่ใช่สิ่งที่เล็กที่สุด แต่อะตอมจะประกอบด้วยอิเล็กตรอน และอนุภาคอื่นๆอีก
- อะตอมประกอบด้วยอนุภาคอิเล็กตรอนที่มีประจุเป็นลบ อนุภาคโปรตอนมีประจุเป็นบวก
- อะตอมจะมีโปรตอนและอิเล็กตรอนกระจายอยู่ทั่วไปอย่างสม่ำเสมอ
- อะตอมเป็นกลางทางไฟฟ้า เพราะ มีจำนวนประจุบวกเท่ากับประจุลบ
จากทฤษฎีอะตอมของทอมสัน แบบจำลองอะตอมมีลักษณะดังรูปลักษณะแบบจำลองอะตอมของทอมสันแบบจำลองอะตอมของรัทเทอร์ฟอร์ดอะตอมจะประกอบด้วยนิวเคลียสที่มีโปรตอนและนิวตรอนรวมตัวกันอยู่อย่างหนาแน่นอยู่ตรงกลางนิวเคลียสมีขนาดเล็กมากมีมวลมาก และมีประจุบวกส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบและมีมวลน้อยมาก จะวิ่งรอบนิวเคลียสเป็นวงกว้าง การค้นพบนิวตรอน เนื่องจากมวลของอะตอมส่วนใหญ่อยู่ที่นิวเคลียสซึ่งเป็นมวลของโปรตอนแต่โปรตอนมีมวลประมาณครึ่งหนึ่งของนิวเคลียสเท่านั้น แสดงว่าต้องมีอนุภาคซึ่งไม่มีประจุไฟฟ้าแต่มีมวลใกล้เคียงกับโปรตอนอยู่ในอะตอมด้วย เจมส์ แชวิก นักวิทยาศาสตร์ชาวอังกฤษ จึงศึกษาทดลองเพิ่มเติมจนพบนิวตรอนซึ่งเป็นกลางทางไฟฟ้า อะตอมของธาตุทุกชนิดในโลกจะมีนิวตรอนเสมอ ยกเว้นอะตอมของไฮโดรเจนในรูปของไอโซโทปสรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้างจากทฤษฎีอะตอมของ รัทเทอร์ฟอร์ด แบบจำลองอะตอมมีลักษณะดังรูปลักษณะแบบจำลองอะตอมของรัทเทอร์ฟอร์ดแบบจำลองอะตอมของนีลส์โบร์นักวิทยาศาสตร์ได้พยายามศึกษาลักษณะของการจัดอิเล็กตรอนรอบๆ อะตอม โดยแบ่งการศึกษาออกเป็น 2 ส่วน ส่วนแรกเป็นการศึกษษเกี่ยวกับสเปกตรัมของอะตอม ซึ่งทำให้ทราบว่าภายในอะตอมมีการจัดระดับพลังงานเป็นชั้นๆ ในแต่ละชั้นจะมีอิเล็กตรอนบรรจุอยู่ ส่วนที่สองเป็นการศึกษาเกี่ยวกับพลังงานไอโอไนเซชัน เพื่อดูว่าในแต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุอยู่ได้กี่ตัวสเปกตรัม หมายถึง อนุกรมของแถบสีหรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้น ที่มีความยาวคลื่นต่างๆเรียงลำดับกันไปนีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา สรุปได้ดังนี้
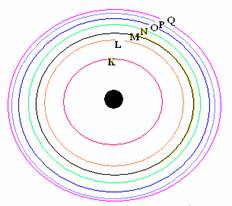
1 . อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆ ตามระดับพลังงาน และแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว
2. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุดยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น ระดับพลังงานจะยิ่งสูงขึ้น
3. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2, n = 3,... ตามลำดับ หรือเรียกเป็นชั้น K , L , M , N ,O , P , Q ....จากทฤษฎีอะตอมของ นีลส์โบร์ แบบจำลองอะตอมมีลักษณะดังรูปลักษณะแบบจำลองอะตอมของนีลส์โบร์แบบจำลองอะตอมแบบกลุ่มหมอกเป็นแบบจำลองที่นักวิทยาศาสตร์คิดว่าเป็นไปได้มากที่สุดทั้งนี้ได้จากการประมวลผลการทดลองและข้อมูลต่างๆ อะตอมภายหลังจากที่นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา อาจสรุปได้ดังนี้
1. อิเล็กตรอนไม่สามารถวิ่งรอบนิวเคลียสด้วยรัศมีที่แน่นอน บางครั้งเข้าใกล้บางครั้งออกห่าง จึงไม่สามารถบอกตำแหน่งที่แน่นอนได้ แต่ถ้าบอกได้แต่เพียงที่พบอิเล็กตรอนตำแหน่งต่างๆภายในอะตอมและอิเล็กตรอนที่เคลื่อนที่เร็วมากจนเหมือนกับอิเล็กตรอนอยู่ทั่วไป ในอะตอมลักษณะนี้เรียกว่า " กลุ่มหมอก"
2. กลุ่มหมอกของอิเล็กตรอนในระดับพลังงานต่างๆจะมีรูปทรงต่างกันขึ้นอยู่กับจำนวนอิเล็กตรอน และระดับพลังงานอิเล็กตรอน
3. กลุ่มหมอกที่มีอิเล็กตรอนระดับพลังงานต่ำจะอยู่ใกล้นิวเคลียสส่วนอิเล็กตรอนที่มีระดับพลังงานสูงจะอยู่ไกลนิวเคลียส
4. อิเล็กตรอนแต่ละตัวไม่ได้อยู่ในระดับพลังงานใดพลังงานหนึ่งคงที่
5. อะตอมมีอิเล็กตรอนหลายๆระดับพลังงาน ลักษณะแบบจำลองอะตอมแบบกลุ่มหมอกสรุปแบบจำลองอะตอมอนุภาคมูลฐานของอะตอมชนิดของอนุภาคมูลฐานของอะตอมทุกอะตอมประกอบด้วยอนุภาคที่สำคัญคือ โปรตอน, นิวตรอน และอิเล็กตรอน โดยมีโปรตอนกับนิวตรอนอยู่ภายในนิวเคลียส นิวเคลียสนี้จะครอบครองเนื้อที่ภายในอะตอมเพียงเล็กน้อย และมีอิเล็กตรอนวิ่งรอบๆ นิวเคลียสด้วยความเร็วสูง คล้ายกับมีกลุ่มประจุลบปกคลุมอยู่โดยรอบ
ลักษณะแบบจำลองอะตอมแบบกลุ่มหมอกสรุปแบบจำลองอะตอมอนุภาคมูลฐานของอะตอมชนิดของอนุภาคมูลฐานของอะตอมทุกอะตอมประกอบด้วยอนุภาคที่สำคัญคือ โปรตอน, นิวตรอน และอิเล็กตรอน โดยมีโปรตอนกับนิวตรอนอยู่ภายในนิวเคลียส นิวเคลียสนี้จะครอบครองเนื้อที่ภายในอะตอมเพียงเล็กน้อย และมีอิเล็กตรอนวิ่งรอบๆ นิวเคลียสด้วยความเร็วสูง คล้ายกับมีกลุ่มประจุลบปกคลุมอยู่โดยรอบ
อนุภาค
|
ประจุ ( หน่วย)
|
ประจุ (C)
|
มวล (g)
|
มวล (amu)
|
อิเล็กตรอน
|
-1
|
1.6 x 10 -19
|
0.000549
|
9.1096 x 10 -28
|
โปรตอน
|
+1
|
1.6 x 10 -19
|
1.007277
|
1.6726 x 10 -24
|
นิวตรอน
|
0
|
0
|
1.008665
|
1.6749 x 10 -24
|
' อิเล็กตรอน (Electron) สัญลักษณ์ e - มีแระจุลบ และมีมวลน้อยมาก
' โปรตอน สัญลักษณ์ p + มีประจุเป็นบวก และมีมวลมากกว่า อิเล็กตรอน ( เกือบ 2,000 เท่า)
' นิวตรอน สัญลักษณ์ n มีประจุเป็นศูนย์ และมีมวลมากพอๆ กับโปรตอน
เลขอะตอม เลขมวล และสัญลักษณ์นิวเคลียร์1. จำนวนโปรตอนในนิวเคลียสเรียกว่า เลขอะตอม (atomic number, Z)
2. ผลบวกของจำนวนโปรตอนกับนิวตรอนเรียกว่า เลขมวล (mass number, A)
A = Z + N โดยที่ N เป็นจำนวนนิวตรอน
( เลขเชิงมวลจะเป็นจำนวนเต็มและมีค่าใกล้เคียงกับมวลของอะตอม)
การเขียนสัญลักษณ์นิวเคลียร์
เขียน (A) ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุ
เขียน (Z) ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุ
X = สัญลักษณ์ของธาตุ
คำศัพท์ที่ควรทราบ
ไอโซโทป ( Isotope ) หมายถึง อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน เช่น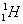
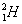
ไอโซบาร์ ( Isobar ) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน แต่มีเลขอะตอมไม่เท่ากัน เช่น
ไอโซโทน ( Isotone ) หมายถึง อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน เช่น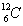
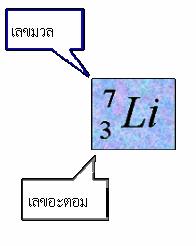
การหาอนุภาคมูลฐานของอะตอม จากสัญลักษณ์นิวเคลียร์ดังนั้น อะตอมของธาตุลิเทียม ( Li )
มีจำนวนโปรตอน = 3 ตัว
อิเล็กตรอน = 3 ตัว
และนิวตรอน = 4 ตัว
การจัดเรียงอิเล็กตรอนหลักในการจัดเรียงอิเล็กตรอนในอะตอม
1. อิเล็กตรอนที่วิ่งอยู่รอบๆ นิวเคลียสนั้น จะอยู่กันเป็นชั้นๆตามระดับพลังงาน ระดับพลังงานที่อยู่ใกล้นิวเคลียสที่สุด ( ชั้น K) จะมีพลังงานต่ำที่สุด และอิเล็กตรอนในระดับพลังงานชั้นถัดออกมาจะมีพลังงานสูงขึ้นๆ ตามลำดับ พลังงานของอิเล็กตรอนของระดับชั้นพลังงาน K < L < M < N < O < P < Q
หรือชั้นที่ 1< 2 < 3 < 4 < 5 < 6 < 7
แบบจำลองอะตอมของนีลส์โบร์2. ในแต่ละชั้นของระดับพลังงาน จะมีจำนวนอิเล็กตรอนได้ ไม่เกิน 2n 2 เมื่อ n = เลขชั้น ซึ่งเลขชั้นของชั้น K=1,L=2,M=3,N=4,O=5,P=6 และ Q=7
ตัวอย่าง จำนวน e - ในระดับพลังงานชั้น K มีได้ ไม่เกิน 2n 2 = 2 x 1 2 = 2x1 = 2
จำนวน e - ในระดับพลังงานชั้น N มีได้ ไม่เกิน 2n 2 = 2 x 4 2 = 2x16 = 32
1.4.1 อนุภาคมูลฐานของอะตอมจะเห็นว่ากฎออกเตตมีข้อด้อย คือ เมื่อระดับพลังงานมากกว่า n = 4 จะใช้ไม่ได้ อย่างไรก็ตามในธาตุ 20 ธาตุแรก สามารถใช้การจัดเรียงอิเล็กตรอนตามกฎออกเตตได้ดี
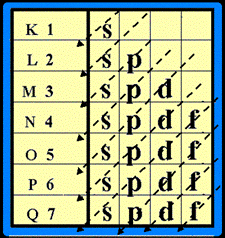
3. ในแต่ละระดับชั้นพลังงาน จะมีระดับพลังงานชั้นย่อยได้ ไม่เกิน 4 ชั้นย่อย และมีชื่อเรียกชั้นย่อย ดังนี้ s , p , d , f
ในแต่ละชั้นย่อย จะมีจำนวน e - ได้ ไม่เกิน ดังนี้
ระดับพลังงานชั้นย่อย s มี e - ได้ ไม่เกิน 2 ตัว ระดับพลังงานชั้นย่อย p มี e - ได้ ไม่เกิน 6 ตัวระดับพลังงานชั้นย่อย d มี e - ได้ ไม่เกิน 10 ตัว ระดับพลังงานชั้นย่อย f มี e - ได้ไม่เกิน 14 ตัว เขียนเป็น s 2 p 6 d 10 f 14
วิธีการจัดเรียงอิเล็กตรอนในอะตอม
การจัดเรียงอิเล็กตรอน ให้จัดเรียง e- ในระดับพลังงานชั้นย่อยโดยจัดเรียงลำดับตามลูกศร ( แนวทางการจัดเรียงอิเล็กตรอน ให้เขียนแผนผังก่อน ดังรูป
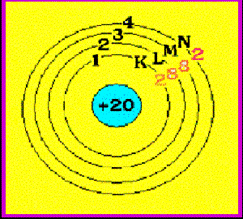
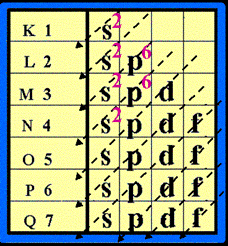
จัดเรียงอิเล็กตรอนตามลูกศร ดังรูปตัวอย่าง จงจัดเรียงอิเล็กตรอนของธาตุ คัลเซียม ( Ca )
ธาตุ Ca มีเลขอะตอม = 20 แสดงว่ามี p = 20 และมี e- = 20 ตัว ( ดูเลขอะตอม จากตารางธาตุ)
แล้วจัดเรียง e- ดังนี้
ดังนั้น การจัดเรียง e- ของธาตุ Ca = 2 , 8 , 8 , 2
มีแผนผังการจัดเรียง e- ดังนี้ Ca มีจำนวน e- ในระดับพลังงานชั้นนอกสุด = 2 ตัว จำนวนอิเล็กตรอนในระดับพลังงานชั้นนอกสุด เรียกว่า เวเลนซ์อิเล็กตรอน (Valence electron) ดังนั้น Ca มีเวเลนซ์อิเล็กตรอน = 2 ดังรูป
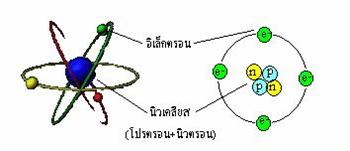
อนุภาคมูลฐานของอะตอม
ทุกอะตอมประกอบด้วยอนุภาคที่สำคัญคือ โปรตอน, นิวตรอน และอิเล็กตรอน โดยมีโปรตอนกับนิวตรอนอยู่ภายในนิวเคลียส นิวเคลียสนี้จะครอบครองเนื้อที่ภายในอะตอมเพียงเล็กน้อย และมีอิเล็กตรอนวิ่งรอบๆนิวเคลียสด้วยความเร็วสูง คล้ายกับมีกลุ่มประจุลบปกคลุมอยู่โดยรอบ
| อนุภาค | ประจุ(หน่วย) | ประจุ(C) | มวล(g) | มวล(amu) |
| อิเล็กตรอน | -1 | 1.6 x 10-19 | 0.000549 | 9.1096 x 10-28 |
| โปรตรอน | +1 | 1.6 x 10-19 | 1.007277 | 1.6726 x 10-24 |
| นิวตรอน | 0 | 0 | 1.008665 | 1.6749 x 10-24 |
อิเล็กตรอน(Electron) สัญลักษณ์ e- มีแระจุลบ และมีมวลน้อยมาก
โปรตอน สัญลักษณ์ p+ มีประจุเป็นบวก และมีมวลมากกว่า อิเล็กตรอน (เกือบ 2,000 เท่า)
นิวตรอน สัญลักษณ์ n มีประจุเป็นศูนย์ และมีมวลมากพอๆกับโปรตอน
หมายเหตุ อนุภาคนิวตรอน ค้นพบโดย เจมส์ แซควิก (James Chadwick) นักวิทยาศาสตร์ชาวอังกฤษ(พ.ศ.2475)
โปรตอน สัญลักษณ์ p+ มีประจุเป็นบวก และมีมวลมากกว่า อิเล็กตรอน (เกือบ 2,000 เท่า)
นิวตรอน สัญลักษณ์ n มีประจุเป็นศูนย์ และมีมวลมากพอๆกับโปรตอน
หมายเหตุ อนุภาคนิวตรอน ค้นพบโดย เจมส์ แซควิก (James Chadwick) นักวิทยาศาสตร์ชาวอังกฤษ(พ.ศ.2475)
เลขอะตอม,เลขมวลและสัญลักษณ์นิวเคลียร์
1. จำนวนโปรตอนในนิวเคลียสเรียกว่า เลขอะตอม(atomic number, Z)
2. ผลบวกของจำนวนโปรตอนกับนิวตรอนเรียกว่า เลขมวล(mass number, A)
A = Z + N โดยที่ N เป็นจำนวนนิวตรอน
(เลขเชิงมวลจะเป็นจำนวนเต็มและมีค่าใกล้เคียงกับมวลของอะตอม)
การเขียนสัญลักษณ์นิวเคลียร์
เขียน(A)ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุ
เขียน(Z)ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุ
X = สัญลักษณ์ของธาตุ
1. จำนวนโปรตอนในนิวเคลียสเรียกว่า เลขอะตอม(atomic number, Z)
2. ผลบวกของจำนวนโปรตอนกับนิวตรอนเรียกว่า เลขมวล(mass number, A)
A = Z + N โดยที่ N เป็นจำนวนนิวตรอน
(เลขเชิงมวลจะเป็นจำนวนเต็มและมีค่าใกล้เคียงกับมวลของอะตอม)
การเขียนสัญลักษณ์นิวเคลียร์
เขียน(A)ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุ
เขียน(Z)ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุ
X = สัญลักษณ์ของธาตุ
การหาอนุภาคมูลฐานของอะตอม จากสัญลักษณ์นิวเคลียร์
ดังนั้น อะตอมของธาตุลิเทียม ( Li ) มีจำนวนโปรตอน = 3 ตัว อิเล็กตรอน = 3 ตัว และนิวตรอน = 4 ตัว
1.4.2 สัญลักษณ์นิวเคลียร์
Z คือ เลขอะตอม (atomic number) เป็นจำนวนโปรตอนในนิวเคลียส
A คือ เลขมวล (mass number) เป็นผลบวกของจำนวนโปรตอนกับนิวตรอน
อะตอมของธาตุเป็นกลางทางไฟฟ้า (จำนวนโปรตอน = จำนวนอิเล็กตรอน)
มีจำนวนโปรตอน = 80 อนุภาค
อิเล็กตรอน = 80 อนุภาค
และนิวตรอน = 201 - 80 = 121 อนุภาคตัวอย่างที่ 2 การหาอนุภาคมูลฐานของอะตอมจากสัญลักษณ์นิวเคลียร์ดังนั้น อะตอมของธาตุแคลเซียม (Ca)
มีจำนวนโปรตอน = 20 อนุภาค
แคลเซียม +2 หมายถึง มีอิเล็กตรอนน้อยกว่าโปรตอน 2 อนุภาค
อิเล็กตรอน = 20 - 2 = 18 อนุภาค
และนิวตรอน = 40 - 20 = 20 อนุภาคตัวอย่างที่ 3 การหาอนุภาคมูลฐานของอะตอมจากสัญลักษณ์นิวเคลียร์ดังนั้น อะตอมของธาตุออกซิเจน (O)
มีจำนวนโปรตอน = 8 อนุภาค
ออกซิเจน -2 หมายถึง มีอิเล็กตรอนมากกว่าโปรตอน 2 อนุภาค
อิเล็กตรอน = 8 + 2 = 10 อนุภาค
และนิวตรอน = 16 - 8 = 8 อนุภาค
1.4.3 การจัดเรียงอิเล็กตรอนในอะตอม
- ใช้หลักของเพาลี ในการบรรจุอิเล็กตรอน คือ ในแต่ละออร์บิทัลจะบรรจุอิเล็กตรอนได้อย่างมากที่สุด 2 ตัว (มีสปินต่างกัน)
- ใช้เครื่องหมาย
แทนอิเล็กตรอนที่มีสปินขึ้น (spin up)
- ใช้เครื่องหมาย
แทนอิเล็กตรอนที่มีสปินลง (spin down)
- ใช้เครื่องหมาย
แทนอิเล็กตรอนเดี่ยวในออร์บิทัล
- ใช้เครื่องหมาย
แทนอิเล็กตรอนคู่ในออร์บิทัล
- บรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานต่ำสุดที่ยังว่างก่อน (เรียงลำดับออร์บิทัลตามลูกศรในรูป) จนครบจำนวนอิเล็กตรอนทั้งหมดในอะตอมนั้น การจัดเรียงอิเล็กตรอนแบบนี้จะทำให้อะตอมมีสถานะเสถียรที่สุดเพราะพลังงานรวมทั้งหมดของอะตอมมีค่าต่ำสุด
- การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากันเช่นออร์บิทัล d จะใช้ กฎของฮุนด์ (Hund's rule) คือ"การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน จะบรรจุในลักษณะที่ทำให้มีอิเล็กตรอนเดี่ยวมากที่สุด"
- การบรรจุอิเล็กตรอนที่ทุกๆออร์บิทัล มีระดับพลังงานเป็น degenerate (ระดับพลังงานเท่ากัน) ทุกออร์บิทัลอาจมีอิเล็กตรอนอยู่เต็ม (2 อิเล็กตรอนต่อ 1 ออร์บิทัล) หรือมีอิเล็กตรอนอยู่เพียงครึ่งเดียว (1 อิเล็กตรอนต่อ 1 ออร์บิทัล)
เช่นNe : 1s2, 2s2, 2p6
N : 1s2, 2s2, 2p3 



เรียกว่า การบรรจุเต็ม




เรียกว่า การบรรจุครึ่ง
โครงแบบอิเล็กตรอนแบบบรรจุเต็มจะเสถียรกว่าแบบบรรจุครึ่งและแบบบรรจุครึ่งก็จะเสถียรกว่าแบบอื่นๆเช่น
- 2p6เสถียรกว่า 2p3
- 2p3เสถียรกว่า 2p4
- 3d10เสถียรกว่า 3d9
วิธีทำ บรรจุอิเล็กตรอนในออร์บิทัลต่างๆ ตามระดับพลังงานดังนี้

3p
3s

2p
2s1sจากแผนภาพข้างต้นนำมาเขียนโครงแบบอิเล็กตรอนตามระดับพลังงานในออร์บิทัลที่เพิ่มขึ้นได้เป็นดังนี้1s2 2s2 2p6 3s2 3p3 และทำนองเดียวกันเขียนโครงแบบอิเล็กตรอนใน 18Ar และ 19K ได้ดังนี้18Ar 1s2 2s2 2p6 3s2 3p6
19K 1s2 2s2 2p6 3s2 3p64s1การเขียนโครงแบบอิเล็กตรอนอาจเขียนย่อให้สั้นลง โดยแยกส่วนที่เป็นโครงแบบของแก๊สมีสกุล (nobel gas) ไว้ในวงเล็บ ดังนี้19K [Ar] 4s 1
ตัวอย่าง เขียนโครงแบบอิเล็กตรอนของ 24Cr
1s2 2s2 2p6 3s2 3p63d104s1 หรือเขียนเป็น1s2 2s2 2p6 3s2 3p63d94s2ทั้งนี้เนื่องจากการจัดเป็น filled configuration จะเสถียรกว่า
การเสียอิเล็กตรอนทำให้อิเล็กตรอนเปลี่ยนไปเป็นไอออนบวก อิเล็กตรอนจะหลุดจากระดับย่อยที่มีพลังงานสูงสุดของระดับซึ่งมีค่า n เป็นค่าสุงสุดของอะตอมนั้น
เลขอะตอมมิก ธาตุ โครงแบบอิเล็กตรอน 1 H 1s1 2 [He] 1s2 3 Li [He] 2s1 4 Be [He] 2s2 5 B [He] 2s2 2p1 6 C [He] 2s2 2p2 7 N [He] 2s2 2p3 8 O [He] 2s2 2p4 9 F [He] 2s2 2p5 10 Ne [He] 2s2 2p6 11 Na [Ne] 3s1 12 Mg [Ne] 3s2 13 Al [Ne] 3s23p1 14 Si [Ne] 3s2 3p2
เช่น 33As มีโครงแบบอิเล็กตรอนเป็น
1s2 2s2 2p6 3s23p63d104s24p3 เมื่อเสียอิเล็กตรอนไป 3 ตัว จะเป็น As3+ อิเล็กตรอนทั้ง 3 ตัว ใน 4p จะหลุดออกไปเหลือโครงแบบอิเล็กตรอนของ As3+ เป็น
1s2 2s2 2p6 3s23p63d104s2
ที่มา:https://sites.google.com/site/sarlaeasmbatikhxngsarm4/home/bth-thi-1-thatu-laea-sarprakxbตารางบันทึกผลการทดลอง
ธาตุ Z การจัดเรียงอิเล็กตรอน FLuorine 9 Phosphorus 15
จากการศึกษาเกี่ยวกับธาตุก๊าซเฉื่อย เช่น He Ne Ar Kr พบว่าเป็นธาตุที่โมเลกุลเป็นอะตอมเดี่ยว คือในหนึ่งโมเลกุลของก๊าซเฉื่อยจะมีเพียง 1 อะตอม แสดงว่าเป็นธาตุที่เสถียรมาก ทำให้นักวิทยาศาสตร์สนใจที่จะค้นคว้าถึงเหตุผลที่ทำให้ธาตุเฉื่อยมีความเสถียร และจากการศึกษาโครงสร้างอะตอมของธาตุเฉื่อยมีการจัดเรียงอิเล็กตรอนวงนอกสุดเหมือนกัน คือมี 8 อิเล็กตรอน(ยกเว้น He มี 2 อิเล็กตรอน) เช่น
2He = 2 10Ne = 2 , 8 18Ar = 2 , 8 , 8 36Kr = 2 , 8 , 18 , 8
ส่วนธาตุหมู่อื่นมีการจัดเรียงอิเล็กตรอนในระดับพลังงานชั้นนอกสุด ไม่ครบ 8 เช่น
ธาตุที่มีวาเลนต์อิเล็กตรอนไม่ครบ 8 ในธรรมชาติจะไม่สามารถอยู่เป็นอะตอมเดี่ยวๆได้ ซึ่งแสดงว่าไม่เสถียร ต้องรวมกันเป็นโมเลกุลซึ่งอาจจะมี 2 อะตอมหรือมากกว่า1H = 1 6C = 2 , 4 7N = 2 , 5 8O = 2 , 6
การที่อะตอมของธาตุต่างๆ รวมตัวกันด้วยสัดส่วนที่ทำให้วาเลนต์อิเล็กตรอนเท่ากับ 8 นี้ นักวิทยาศาสตร์ได้ตั้งเป็นกฎขึ้นเรียกว่า กฎออกเตต
การรวมกันเพื่อทำให้อะตอม มีวาเลนต์อิเล็กตรอนครบ 8 อาจมีลักษณะดังนี้
- อะตอมใช้วาเลนต์อิเล็กตรอนร่วมกันเป็นคู่ๆ จะเกิด "พันธะโคเวเลนต์ "
- อะตอม ให้หรือรับอิเล็กตรอน จะเกิดเป็น " พันธะไอออนิค "
- อะตอมใช้วาเลนต์อิเล็กตรอนร่วมกันทั้งก้อน จะเกิดเป็น " พันธะโลหะ "







ไม่มีความคิดเห็น:
แสดงความคิดเห็น